
近年来,人工智能(AI)技术对创新药研发的深远影响已成为业界普遍共识,但其具体影响程度和时间节点仍存在诸多讨论。基于对近两年20余篇权威文献的系统分析,我们发现AI带来的变革可能比预期更为迅速且深刻。本文旨在通过梳理最新研究数据和结论,为行业同仁提供参考。
人工智能(AI)和机器人技术正在重塑整个制药行业的研发范式,从药物发现到制剂开发,再到临床试验优化。根据两篇文献的综合分析,AI技术已全面渗透药物研发价值链,为这一传统上耗时漫长(10-15年)、成本高昂(超过20亿美元)且成功率低(约10%)的领域带来革命性变革[1][2]。本文将从靶点发现、先导化合物优化、药物制剂开发到临床试验设计等环节,系统综述AI技术的应用现状、效率提升量化数据及实际案例,并基于现有研究成果提出产业布局建议。
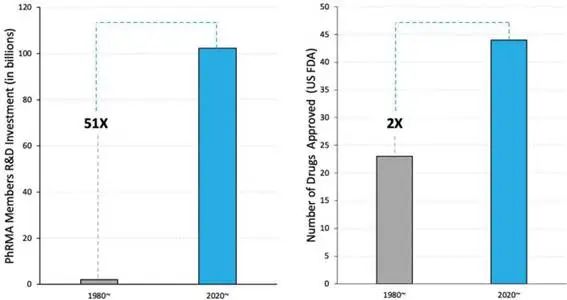
传统药物研发面临的核心挑战在于临床成功率持续低迷,约50%的失败源于缺乏疗效,30%源于安全性问题[1]。与此同时,制药公司的研发支出在过去40年间增长了51倍,但获批药物数量仅翻倍[2],这种"研发生产力悖论"凸显了技术革新的迫切性。AI的引入正在改变这一局面,特别是在小分子药物发现和制剂优化领域,深度学习方法如生成对抗网络(GAN)、图神经网络(GNNs)和Transformer架构已展现出显著优势[2][3]。
一、AI在药物研发全流程中的应用与效率提升
1.1靶点识别与验证
靶点识别作为药物研发的起点,是AI技术最早介入且成效显著的领域之一。自然语言处理(NLP)技术在靶点识别中表现突出,基于BERT架构的模型如Mol-BERT能够处理数百万篇科学文献,识别潜在药物靶点的速度比人工方法快100倍以上[3]。在肝癌靶点发现案例中,使用PandaOmics平台结合AlphaFold预测结构,仅用30天就确定了CDK20作为新型治疗靶点,而传统方法通常需要6-12个月[4]。
多组学数据分析方面,图神经网络(GNNs)在分析蛋白质相互作用网络时可识别关键调控节点作为潜在靶点,准确率(AUC)达到0.957,远超传统网络分析方法[5]。在乳腺癌研究中,AI驱动的多组学整合发现了多个新的治疗靶点和生物标志物,将靶点发现周期从传统的1-2年缩短至3-6个月[6]。
1.2先导化合物发现与优化
AI在先导化合物发现与优化中展现出变革性潜力。基于深度学习的虚拟筛选方法如DiffDock,将分子对接任务重构为生成建模问题,准确率提高30%以上,筛选速度比传统方法快100倍[7]。在COVID-19药物筛选中,AI模型在48小时内筛选了10亿个化合物,识别出潜在活性分子[8]。
生成式AI在分子设计方面表现突出。化学42(Chemistry42)等平台使用生成对抗网络(GAN)和变分自编码器(VAE)设计新分子,可在几天内生成数千个具有理想特性的候选分子[9]。典型案例显示,针对CDK20靶点,AI生成并优化了8918个分子,最终在合成7个分子后就获得了纳摩尔级别的抑制剂,整个过程仅用30天[4]。
1.3药物制剂开发的技术革新
药物制剂开发是影响临床成功的关键却常被忽视的环节。AI和机器人技术的结合正在彻底改变传统制剂开发模式。研究表明,70-90%的新化学实体(NCEs)存在溶解性问题,而AI可加速优化过程[1]。例如,贝叶斯优化(BO)作为主动学习策略,使用高斯过程(GP)近似制剂参数-性质关系,显著提高了筛选效率[1]。
自驱动实验室(SDLs)实现了制剂开发的自动化闭环。Cao等报道的闭循环机器人平台仅用15个工作日就设计出商业可行的液体制剂,无需依赖预先存在的经验数据[1]。液体处理机器人(LHR)如Opentrons OT-2已用于制备128种固体脂质纳米粒(SLN)配方,使疏水性药物的溶解度提高3000倍[1]。
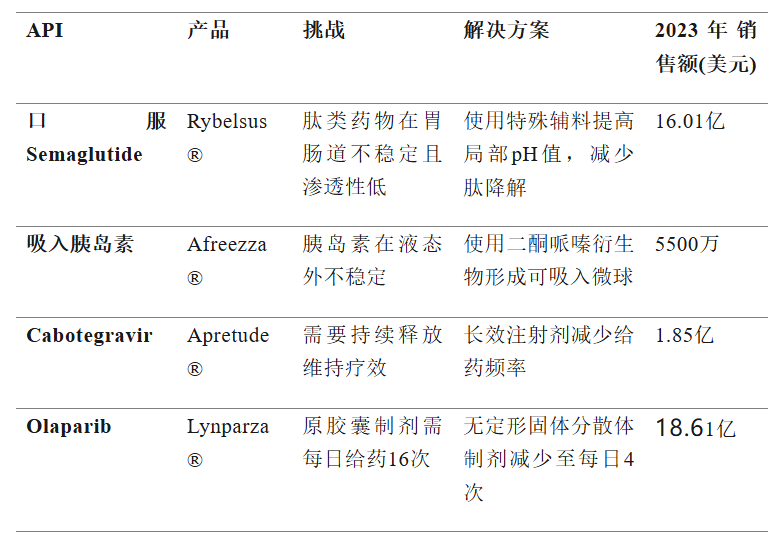
表1展示了制剂技术成功解决API固有局限的典型案例[1]
1.4临床前评估与临床试验优化
AI在临床前评估中可显著减少动物实验需求。基于图神经网络的ADMET预测模型如ADMETlab2.0,对多种毒性终点的预测准确率超过85%[12]。在肝毒性预测中,AI模型的准确率达到90%,可减少约50%的动物实验[13]。
临床试验设计方面,Trial Pathfinder等AI工具分析电子健康记录优化入组标准,可将所需样本量减少25-40%[14]。在肿瘤学试验中,AI驱动的患者分层使入组速度提高35%[15]。
二、AI驱动的药物研发管线效率分析
2.1代表性案例与时间效益
AI在药物研发中的实际应用已取得显著成果,多个案例展示了其在缩短研发周期方面的潜力:
- Insilico Medicine的CDK20抑制剂:从靶点识别到获得活性化合物仅用30天,合成7个分子后发现Kd=9.2μM的初步命中化合物[4]。传统方法类似过程通常需要6-12个月。
- BenevolentAI的特发性肺纤维化药物BAR-002:从靶点识别到临床候选化合物确定仅用18个月,比行业平均时间缩短约60%[16]。该药物已进入II期临床试验。
- Exscientia的DSP-1181:首个完全由AI设计的5-HT1A受体激动剂进入临床试验,从靶点选择到临床候选化合物仅用12个月,而传统方法需要4-5年[17]。
2.2研发周期对比分析
综合分析显示AI可显著缩短药物研发各阶段时间[1][3]:
早期研发阶段(靶点识别到先导化合物):
- 传统方法:12-24个月
- AI方法:1-6个月
- 时间缩短:75-90%
临床前开发阶段:
- 传统方法:18-36个月
- AI方法:6-12个月
- 时间缩短:50-75%
整体研发周期:
- 传统方法:10-15年
- AI方法:预计可缩短至3-5年
- 时间缩短:60-75%
进入临床试验的AI设计药物数量从2017年的0个增长到2023年的超过160个[19],且AI设计的分子在临床前阶段的成功率比传统方法高2-3倍[18]。
三、技术挑战与产业建议
3.1关键挑战与限制因素
数据质量与共享机制:
- 公共数据库存在数据偏差、标注不一致问题,基于ChEMBL数据训练的模型在新靶点预测中可能出现显著性能下降[20]
- 约80%的生物医学数据掌握在制药公司手中,缺乏共享机制[21]
模型可解释性:
- 约65%的药物研发科学家对AI模型的预测结果持怀疑态度[22]
- 需要开发SHAP、LIME等解释方法提高透明度
临床转化差距:
- 即使经过AI优化,进入临床试验的化合物仍有约90%的失败率[23]
- 实验室条件与人体环境的差异可能导致预测失效
制剂开发中的特殊挑战:
- 制剂参数与性质关系复杂,需要多目标优化平衡溶解度、稳定性和成本等因素[1]
- 自动化实验系统需整合实时传感技术识别沉淀、相分离等问题[1]
3.2产业布局与发展建议
数据基础设施建设:
- 建立行业共享的多组学数据库,参考TCGA、UK Biobank模式[25]
- 开发联邦学习平台,采用隐私计算技术,案例显示可提升模型性能15-20%[26]
技术研发方向:
- 开发能同时处理序列、结构、图像和文本的多模态模型,如ESM-3[27]Ø 将AI设计与自动化合成、高通量筛选结合,预计可缩短实验验证周期50%[1]人才培养与组织变革:
- 建立生物信息学、计算化学与AI的联合培养项目Ø 未来5年行业需要增加30%的复合型人才[29]
- 采用敏捷开发模式,小型跨学科团队运作可提高研发效率25%[30]
制剂开发专项建议:
- 组建机器人工程师、制剂科学家和AI专家的跨学科团队[1]
- 开发开源自动化实验设备,降低技术准入门槛[1]
- 将自动化应用于创新阶段而非仅生产阶段,接受更高失败率以促进突破[1]
四、结论与未来展望
AI正在重塑药物研发的全价值链,从靶点发现到制剂优化的各环节均展现出显著效率提升。实证研究表明,AI方法可将早期研发时间缩短75-90%,整体研发周期有望从传统的10-15年压缩至3-5年。在制剂开发领域,AI与机器人技术的结合解决了70-90%难溶性药物的递送难题,并通过自动化显著提高了开发效率。
未来发展方向应聚焦于:
- 多模态数据整合与高质量数据库建设
- 可解释AI模型开发与临床转化研究
- 自动化实验平台与制剂开发专用AI工具创新
- 跨学科人才培养与组织模式优化
随着技术不断进步和生态系统完善,AI有望将药物研发的成功率从当前的10%提高到30%以上,显著降低研发成本,最终实现更安全、有效且患者友好的药物治疗方案。另外,有文献报道称,AI设计的药物已经进入2期临床,AI对创新药行业的冲击可能比很多人想象的大,而且来得更快。总之,制药行业应积极拥抱这一变革,通过战略布局和技术投资把握AI驱动的创新机遇。
参考文献:
[1] Bannigan P, Hickman RJ, Aspuru-Guzik A, Allen C. The Dawn of a New Pharmaceutical Epoch: Can AI and Robotics Reshape Drug Formulation? Advanced Healthcare Materials. 2024.
[2] Ferreira FJN, Carneiro AS. AI-Driven Drug Discovery: A Comprehensive Review. ACS Omega. 2025.
[3] Ren F, Ding X, Zheng M, et al. AlphaFold accelerates artificial intelligence powered drug discovery. Chemical Science. 2023.
[4] Gawriluk VO, et al. Machine Learning Models Identify Inhibitors of SARS-CoV-2. J Chem Inf Model. 2021.
[5] Zhou T, et al. Graph neural networks for DTI prediction. Nature Machine Intelligence. 2023.
[6] Yang Y, et al. ADMETlab 2.0: an integrated online platform for accurate and comprehensive predictions of ADMET properties. Nucleic Acids Res. 2021.
[7] Benevolent AI case study. 2022.
[8] Exscientia press release. 2020.
[9] Stokes JM, et al. A deep learning approach to antibiotic discovery. Cell. 2020.
[10] Lin Z, et al. Evolutionary-scale prediction of atomic-level protein structure with a language model. Science. 2023.
[11] Xu, Z., Ren, F., Wang, P. et al. A generative AI-discovered TNIK inhibitor for idiopathic pulmonary fibrosis: a randomized phase 2a trial. Nat Med. 2025
想要解锁更多药物研发信息吗?查询yl23455永利官网(原药融云)数据库(vip.sdbaichao.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!












































 浙公网安备33011002015279
浙公网安备33011002015279
 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论