
今日,CDE公布的上市申请受理目录,乙酰半胱氨酸注射液已有4家企业的化药4类上市申请已被受理,分别是浙江赛默、四川科伦、广州大光、广州君博。
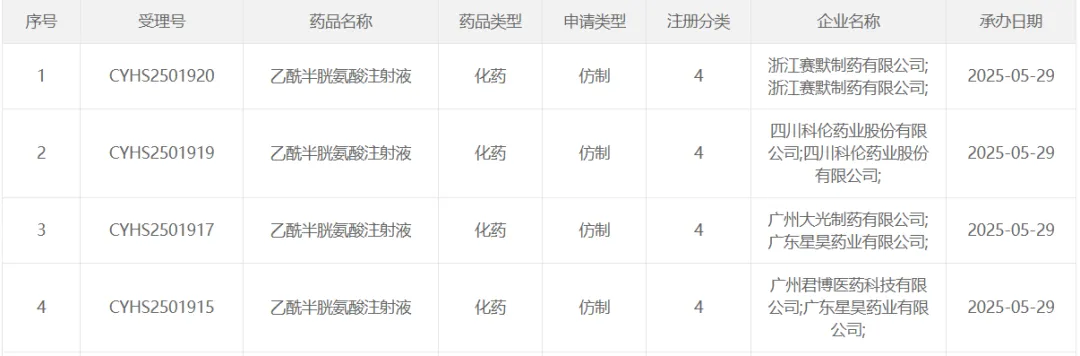
5月21日,精鼎医药持有的原研赞邦的乙酰半胱氨酸注射液(3ml:0.3g)才获批上市。
同一天四家被受理,而距离赞邦在国内获批才刚过去8天。仿制药跟进速度记录,又一次被刷!
早在赞邦尚在进行该品种补充申请时,就已有业内人士透露,部分仿制药企业资料已准备完全,就等赞邦获批,随时可以上报。
果不其然,相隔8天,就已初见成效。行业预计,一个月左右,乙酰半胱氨酸注射液以4类申报仿制的企业就将达十几家。
乙酰半胱氨注射液这一仿制被驳回了二十多次的产品,因为原研上市而迎来了转机。而与乙酰半胱氨注射液同为难兄难弟的乙酰半胱氨酸口服溶液,现今又是如何呢?
结论就是,同样没有企业顺利过评,同样连续被驳回。
这两个品种原研均是赞邦,同样是真溶液,成分相同,功效也类似,用于浓稠粘液分泌物过多的呼吸道疾病,用于疏通粘液、促进排痰。
乙酰半胱氨酸口服溶液原研未在国内上市,一般来说,一个真溶液,就算原研未在国内上市,仿制大概率也可豁免临床和BE,当时乙酰半胱氨酸口服溶液,立项企业同样非常多,争相提交上市申请。
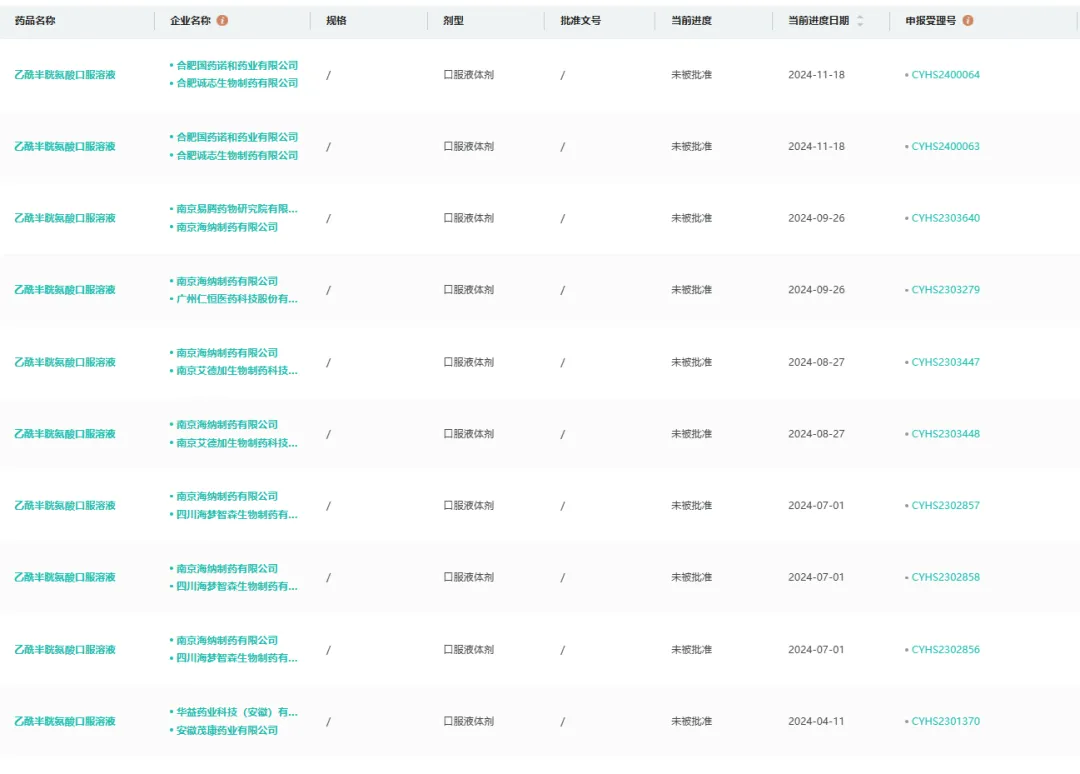
结果乙酰半胱氨酸口服溶液跟隔壁注射液一样,接连被驳回。
2024年4月11日,安徽茂康药业率先收到了药品通知件,未被批准,此后四川海梦智森、南京艾德加、广州仁恒、南京易腾、合肥国药诺和接连收到通知件。
据业内人士称,安徽茂康药业仿制申请未被批准的原因是:未做BE(生物等效性试验)。
安徽茂康药业在收到通知件之前的2月26日,就登记了BE试验,推断早就接到了评审中心的反馈信息,提前进行了布局,后续被驳回的企业推断可能均为此原因。
截至目前,未进行BE试验就提交上市申请的企业均已收到通知件。更糟糕的是,原研赞邦并没有打算在国内上市口服制剂,在2016年临床申请不批准后,已停止国内的上市流程。
但似乎,乙酰半胱氨酸口服溶液比注射液幸运一点,不用等原研先上市,也不用进行验证性临床,只需要补一个BE试验。
目前两家尚在走审批流程的企业,舒美奇和重新提交的安徽康茂药业均是完成BE试验后提交的上市申请。
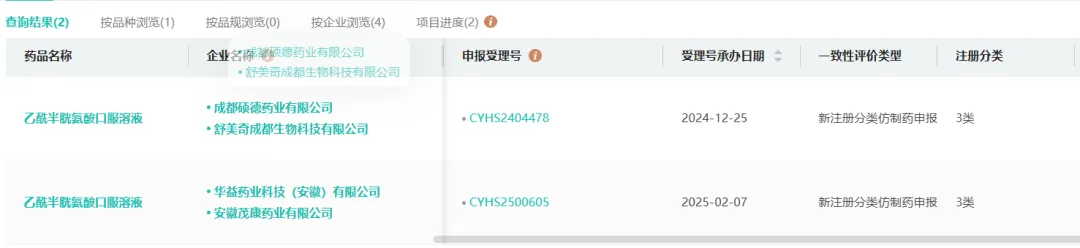
目前该品种登记了BE试验的企业已达10家。
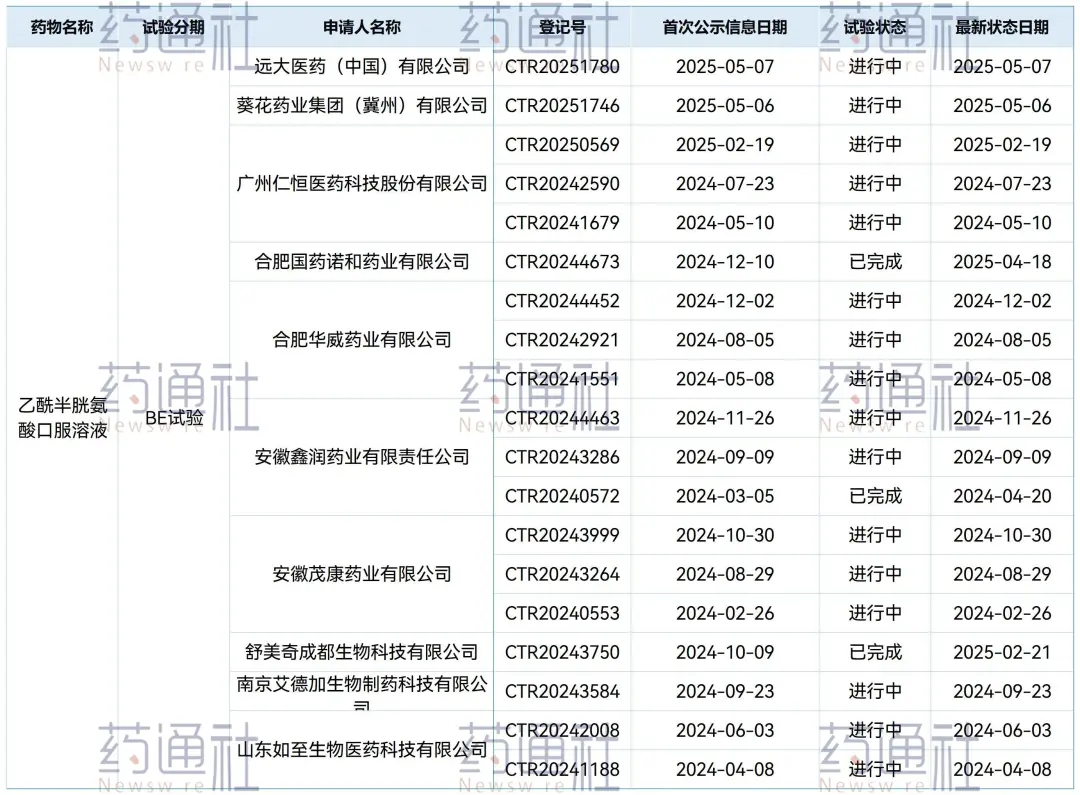
乙酰半胱氨酸口服溶液为什么仅需进行BE试验?
业内推测:同成分同给药途径的乙酰半胱氨酸颗粒原研富露施(同赞邦公司生产)已在国内上市多年,颗粒剂型在国内已经有大量的安全性和有效性数据。
如果BE试验结果显示,口服溶液和颗粒剂在生物等效性一致,那就意味着口服溶液像颗粒剂那样,对中国人群安全有效。
事实证明,多家企业的乙酰半胱氨酸口服溶液BE试验选择的对照药是就是其颗粒剂。
当然也有非常谨慎的企业,比如安徽茂康药业,BE试验做了三次,分别选用了未在国内上市的口溶液剂型和已在国内上市的颗粒剂和片剂。
另一家已提交上市的舒美奇为了赶进度则只做了同颗粒剂的BE试验。
乙酰半胱氨酸这一成分的注射液和口服溶液以目前申报情况来看,都已有了明确的审核方向,现今企业最该关注的成了这两种剂型还要不要跟进,跟进能不能有收益等等。
后续市场如何做?立项是否跟进?任何一个决策,对于整个企业的未来发展都至关重要。
想要解锁更多药品信息吗?查询yl23455永利官网(原药融云)数据库(vip.sdbaichao.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!











































 浙公网安备33011002015279
浙公网安备33011002015279
 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论